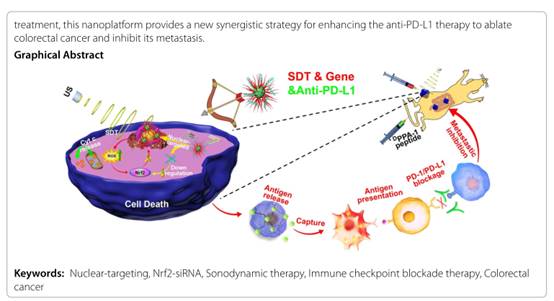
我院納米生物醫(yī)用材料研究中心最近報道了一種基因增強的細胞核靶向聲動力治療(SDT)納米治療體系能夠極大程度上誘導腫瘤細胞免疫原性死亡(ICD)�����,聯(lián)合基于多肽的免疫檢查點阻斷療法(ICB)能夠較好地消除結腸癌并抑制結腸癌的腸道轉移���,并研究了其發(fā)揮作用的生物學機制��。論文“Gene augmented nuclear-targetingsonodynamic therapy via Nrf2 pathway-based redox balance adjustment boosts peptide-based anti-PD-L1 therapy on colorectal cancer”于2021年10月29日在期刊《Journal of Nanobiotechnology》(中科院二區(qū)����,五年IF 9.151)上線。我校生命科學技術學院為第一作者單位����,我院萬國運博士、研究生陳續(xù)恒�、王海蛟博士為第一作者,納米中心張其清教授�、陳紅麗教授為通訊作者。
文獻報道�,多種治療手段均可誘導腫瘤免疫原性死亡從而激活機體的免疫系統(tǒng)發(fā)揮抗腫瘤作用,自由基誘導的腫瘤細胞凋亡在誘導腫瘤ICD方面表現(xiàn)突出�,其中聲動力由于其優(yōu)越的穿透深度而備受關注。然后�����,腫瘤細胞內存在的天然的氧化還原平衡調節(jié)機制�����,在SDT誘導腫瘤細胞內ROS水平上升后���,基于Nrf2的活性氧清除通路被激活��,從而加速活性氧清除�,減弱SDT的殺傷作用。
本研究利用穿膜肽TAT修飾的聲敏劑實現(xiàn)細胞核靶向的SDT治療作用��,直接損傷腫瘤細胞DNA���,抑制其增殖���;同時利用TAT強大的正電荷吸附Nrf2-siRNA關閉SDT后的活性氧清除通路,增強SDT殺傷作用�。結果表明這種基因增強的核靶向SDT可以較好地誘導結腸癌細胞發(fā)生ICD,與基于抗PD-L1多肽DPPA-1聯(lián)用可以更好地消除結腸癌�,激活的免疫效應可以一定程度上抑制結腸癌的腸道轉移。
本工作得到了天津醫(yī)科大學和深圳市第一人名醫(yī)院相關研究人員的鼎力幫助���,在此表示感謝���。(文陳紅麗����,圖萬國運)

論文鏈接:https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-021-01094-x